Ablynx
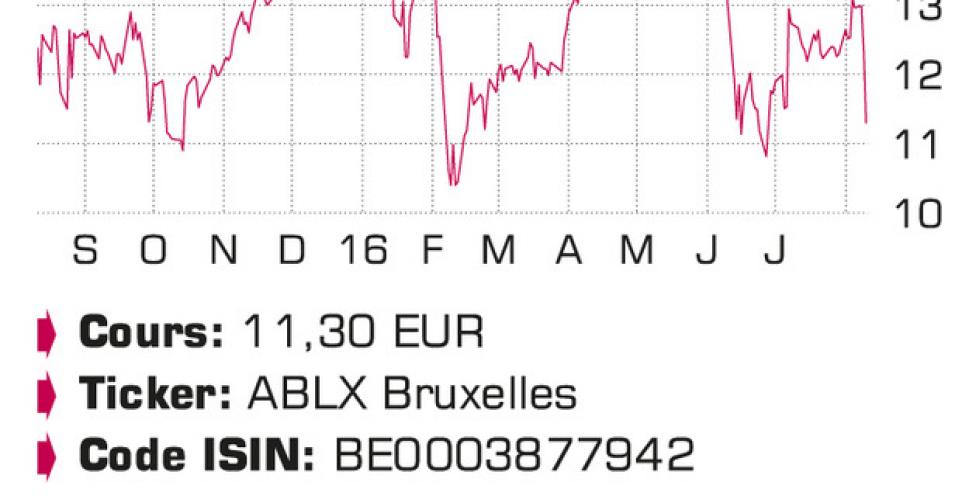
Le marché estime qu’une prise en licence du Vobarilizumab par AbbVie est peu probable. Nous prévoyons une volatilité persistante d’ici à ce que la décision soit connue mais confirmons la note “digne d’achat”. Pour l’investisseur conscient du risque.
Après les résultats positifs de l’étude sur l’ALX-0061 ou Vobarilizumab, un médicament contre le rhumatisme (anti-IL/6R) en monothérapie (251patients), on attendait avec impatience ceux de l’étude en thérapie combinée pour laquelle 345patients avaient été recrutés. Outre du méthotrexate, ils se sont vu administrer en sous-cutané soit un placebo, soit un des quatre régimes de Vobarilizumab (toutes les deux ou quatre semaines, et à chaque fois deux dosages). Le critère d’évaluation primaire était l’ACR20 après 12semaines de traitement, une méthode de mesure standard dans les études de rhumatologie, basée sur l’évolution du nombre d’articulations douloureuses ou gonflées et sur cinq autres paramètres souvent subjectifs. L’ACR20 est positif en cas d’amélioration de 20% du premier paramètre et de satisfaction de trois des cinq autres paramètres. Généralement, les patients qui se voient administrer un placebo affichent un ACR20 de 45 à 50%, mais cette fois, il a atteint 62%, et même 74% après 24semaines de traitement. Vu le caractère partiellement subjectif du score ACR, il est possible que le protocole d’étude imposé ait joué un rôle: en raison de la période limitée de l’étude du Vobarilizumab administré en sous-cutané, il ne permettait en effet pas aux patients placebo qui n’affichaient pas un ACR20 positif après 12semaines de passer au Vobarilizumab. Les patients savaient donc qu’en cas d’ACR20 négatif, ils perdraient toute chance de participer à l’étude de suivi sur deux ans (94% des patients y participeront). Les scores ACR20 du Vobarilizumab sont impressionnants: jusqu’à 81% après 12semaines et jusqu’à 79% après 24semaines. Le Vobarilizumab s’est montré significativement plus performant sur les critères ACR50 (amélioration de 50%) et ACR70 (70%) plus difficiles à atteindre: ACR50 jusque 45% (12semaines) et jusqu’à 59% (24semaines), contre 28% et 39% pour le placebo, et ACR70 jusque 21% (12semaines) et jusque 43% (24semaines), contre 9% et 17%. Ces résultats sont meilleurs que ceux des produits concurrents. Le tableau est similaire dans le score de rémission DAS28, moins subjectif, mais crucial d’un point de vue clinique: jusqu’à 49%, contre 17% pour le placebo, et à nouveau meilleur que la concurrence. Le médicament obtient également d’excellents résultats en matière de sécurité et d’effets secondaires, au moins aussi bons que les produits concurrents. Reste à attendre à présent la décision d’AbbVie qui, en cas de prise en licence, assumera tous les frais de développement ultérieurs, et Ablynx aura droit à un paiement d’étape de 75millions USD. La décision devrait être connue avant la fin de l’année. La direction a déjà indiqué qu’en cas de décision négative d’AbbVie, Ablynx lancerait elle-même une étude de phaseIII, et rechercherait un nouveau partenaire en parallèle. Le marché a d’abord réagi positivement aux dernières informations, mais les doutes sont rapidement réapparus.
Conclusion
Le marché estime qu’une prise en licence du Vobarilizumab est peu probable. Nous prévoyons une volatilité persistante en attendant la décision d’AbbVie, mais confirmons la note “digne d’achat”. La valeur de marché actuelle de 700millions EUR représente à peine plus que la valeur actuelle du Caplacizumab (médicament contre les maladies du sang) et la position de trésorerie (environ 40%). Le risque reste cependant supérieur à la moyenne!
Conseil : digne d’achat
Risque : élevé
Rating : 1C
Actions belges
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici