Inventiva s’offre de nouvelles ambitions

Source: Newsgate
3 min. de lecture
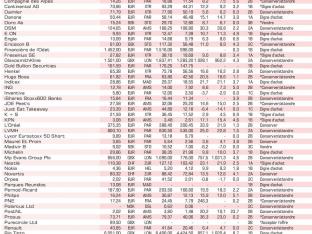
Actions européennes
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici