Mithra Pharmaceuticals déçoit
Source: Newsgate
2 min. de lecture
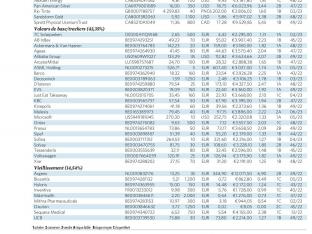
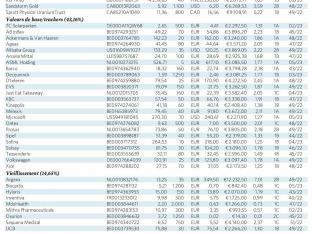
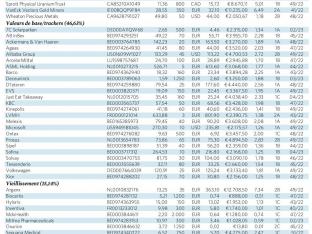
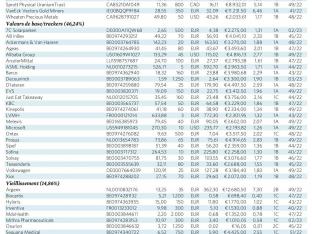
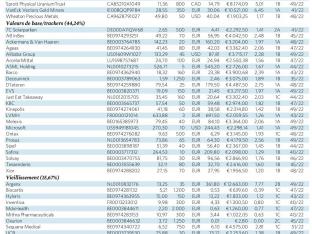
Sélection de nos actions
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici